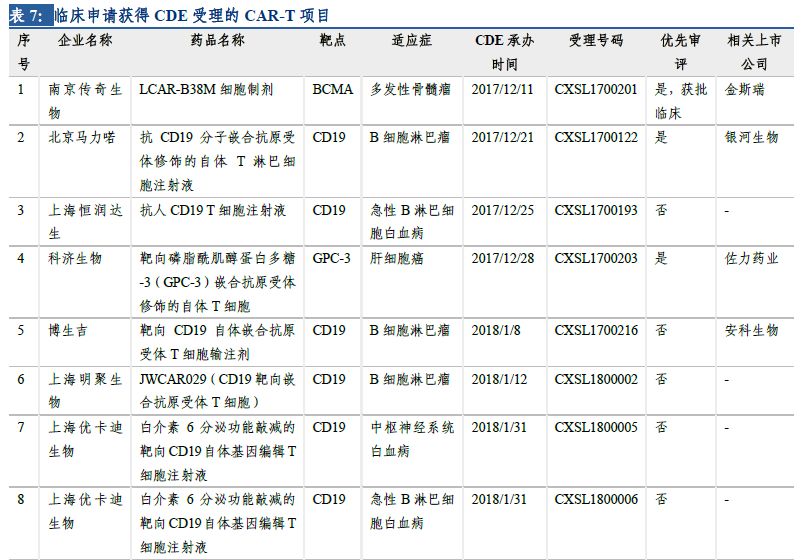
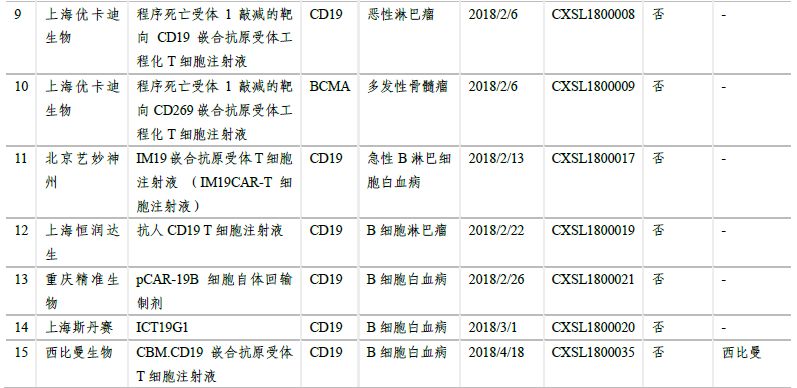
在日益增長的病患需求�����、不斷推進的監(jiān)管制度和大量資金投入研發(fā)及合作的情況下���,國內(nèi)的細胞治療產(chǎn)業(yè)發(fā)展迅速���,目前已形成了近百家不同規(guī)模的公司。南京傳奇生物的CAR-T療法獲得國內(nèi)首個按藥物申報的臨床批件��。截至2018年5月���,另有13家企業(yè)的19個CAR-T項目臨床申請獲得CDE受理�,絕大多數(shù)都是以CD19為靶點。預計未來3-5年�����,國產(chǎn)CAR-T產(chǎn)品將陸續(xù)上市��。
1.CAR-T細胞免疫療法簡介
CAR-T細胞免疫療法(Chimeric Antigen Receptor T-Cell Immunotherapy)指的是嵌合抗原受體T細胞免疫療法���,是細胞免疫療法的一種���,也是目前臨床上較為有效的治療惡性腫瘤的方式之一。
1.1 治療原理及特點
CAR-T的治療原理是從腫瘤患者外周血中分離出自身T細胞��,通過基因轉(zhuǎn)導的方法��,將能特異性識別腫瘤抗原的CAR結(jié)構(gòu)轉(zhuǎn)入T細胞��,體外擴增培養(yǎng)后�,回輸患者體內(nèi),殺傷具有相應(yīng)特異性抗原的腫瘤細胞�。細胞免疫治療的本質(zhì)上是通過人體自身免疫系統(tǒng)對病變組織進行攻擊,故治療效果更為顯著���,潛在的毒副作用相對更可控���。因輸入的免疫細胞可在患者體內(nèi)增殖��,故治療的持久性也更有保障�。
CAR-T細胞免疫治療在臨床試驗中顯示出良好的靶向性���、殺傷性和持久性����,在治療血液腫瘤方向有突破性進展��,并且正在嘗試用于實體瘤�����,具有廣闊的發(fā)展空間�����。
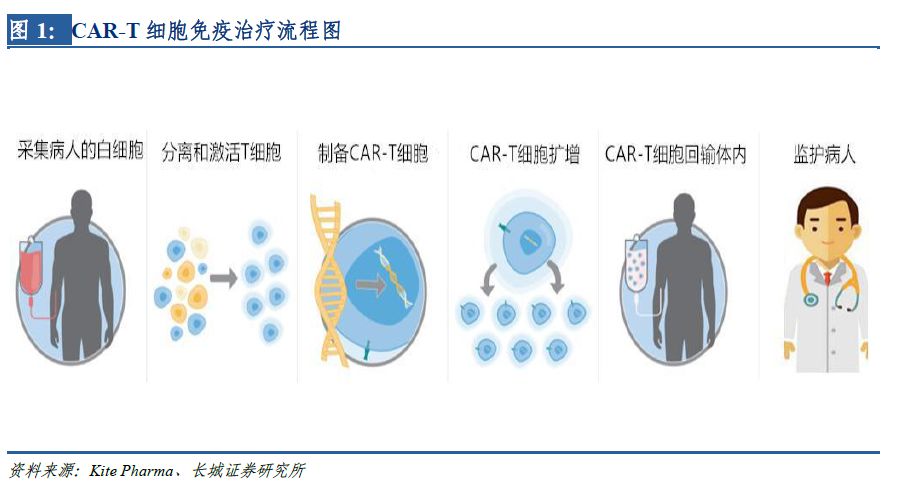
1.2 較傳統(tǒng)療法優(yōu)勢顯著
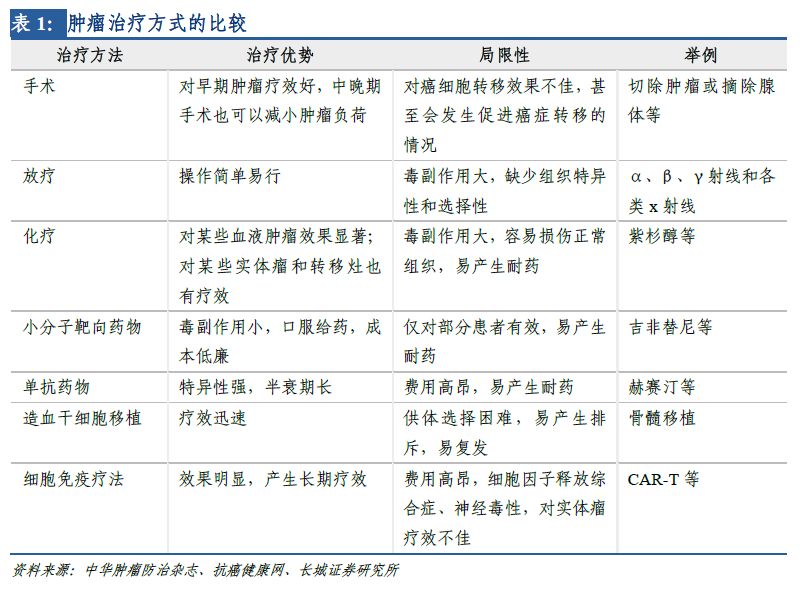
傳統(tǒng)腫瘤治療方法主要有:手術(shù)切除�����、放化療�、小分子靶向藥物、單抗藥物以及造血干細胞移植�����。其中�,手術(shù)切除僅對早期患者有效,若癌細胞轉(zhuǎn)移則效果不佳�;放化療較普遍,但選擇性差���,對正常組織損傷大����;靶向藥物(包括小分子和單抗)綜合療效較好���,毒副作用相對較小�����,但也面臨刺激腫瘤細胞基因變異�、產(chǎn)生藥物耐受性等問題�����。造血干細胞移植療效迅速,但往往供體選擇困難���,且術(shù)后易發(fā)生排斥反應(yīng)�。細胞免疫療法是腫瘤治療最前沿領(lǐng)域�����,臨床數(shù)據(jù)顯示�,相較其它腫瘤治療方法,CAR-T療法具備以下多方面優(yōu)勢:
?更“精準”:由于CAR-T細胞是應(yīng)用基因修飾病人自體的T細胞����,利用抗原-抗體結(jié)合的機制,能克服腫瘤細胞通過下調(diào)MHC分子表達以及降低抗原遞呈等免疫逃逸��。
?更“靈活”:CAR-T既可以利用腫瘤細胞的蛋白質(zhì)抗原��,又可利用腫瘤細胞的糖脂類非蛋白質(zhì)抗原���,擴大了腫瘤抗原靶點范圍。
?更“廣譜”:鑒于很多腫瘤細胞表達相同的腫瘤抗原�����,針對某一種腫瘤抗原的CAR基因構(gòu)建一旦完成,便可以被廣泛利用��。
?更“持久”:通過基因工程修飾可在CAR-T結(jié)構(gòu)中加入促進T細胞增殖與活化的基因序列��,能保證T細胞進入人體后還可以增殖�。CAR-T細胞具有免疫記憶功能,可以長期在體內(nèi)存活���。
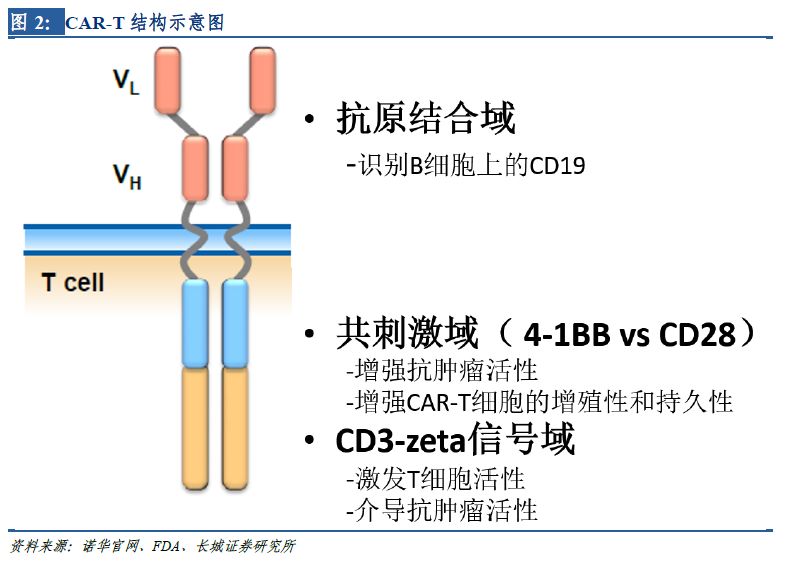
1.3 目前上市產(chǎn)品
2017年����,F(xiàn)DA批準了2個CAR-T產(chǎn)品上市:
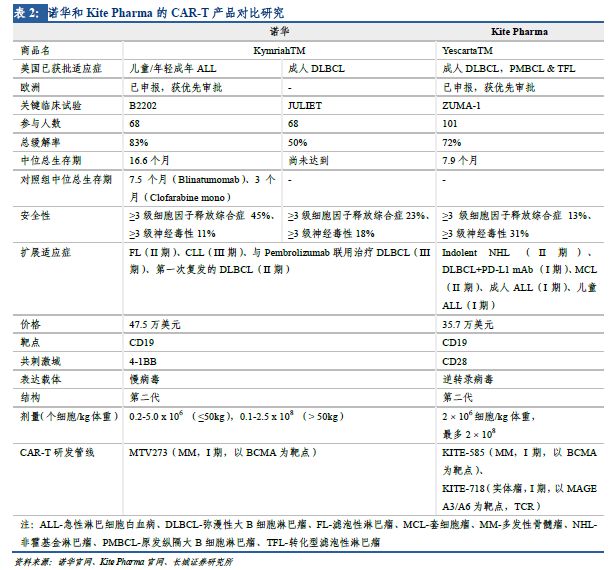
諾華的CAR-T療法Kymriah(Tisagenlecleucel����,CTL019)、���,Kite Pharma 的CAR-T產(chǎn)品Yescarta�。2個產(chǎn)品具有類似的結(jié)構(gòu)���。首先���,都以CD19 蛋白為靶點��。CD19在B細胞白血病和淋巴瘤中廣泛表達�����,是CAR-T技術(shù)研究相對成熟也是研發(fā)最熱門的靶點�;其次���,皆為第二代CAR-T��,相比第一代多了細胞內(nèi)共刺激分子�����,有利于增強抗腫瘤活性�����,且CAR-T細胞的增殖性和持久性都更強���。第二代CAR-T有較多的臨床數(shù)據(jù)支持�����,穩(wěn)定性高且技術(shù)工藝較為成熟,是目前的主流技術(shù)����。未來,隨著新結(jié)構(gòu)在臨床上的試驗推廣及生產(chǎn)工藝的改進�,第三代、第四代CAR-T產(chǎn)品更為優(yōu)良的療效值得期待���。
2.國內(nèi)外研發(fā)動態(tài)
2.1 CAR-T
2017年����,CAR-T研究進入白熱化階段��,主要由歐美制藥企業(yè)引領(lǐng)��。其中�,諾華、KitePharma和JunoTherapeutics是該領(lǐng)域的三只領(lǐng)頭羊�����,無論從產(chǎn)品研發(fā)����、臨床研究還是學術(shù)推廣上都有較為深厚的積淀����。
諾華和KitePharma
諾華和KitePharma處于全球CAR-T研發(fā)第一梯隊�,分別上市了全球首個和第二個CAR-T產(chǎn)品,在腫瘤免疫治療上具有劃時代的意義���。兩個企業(yè)均就已在美獲批的適應(yīng)癥向歐洲EMA提交了Kymriah和Yescarta的上市申請�����,且就諸多其他適應(yīng)癥積極開展臨床試驗�,若實驗進展順利�����,預計未來5年可獲批治療其他多種類型腫瘤�。同時,兩家公司也在開發(fā)針對其他靶點的CAR-T產(chǎn)品(見表2)���,主要是以BCMA為靶點治療多發(fā)性骨髓瘤���,均處于臨床I期���。
Juno和Celgene
JunoTherapeutics致力于腫瘤細胞免疫研究���,是該領(lǐng)域的先驅(qū)公司之一�����,其JCAR015進度靠前�,本有希望成為第一款獲批的CAR-T產(chǎn)品�。但在2016年7月和11月,相繼有3名和2名急性淋巴細胞白血病患者在接受JCAR015治療的II期臨床試驗時���,因神經(jīng)毒性引發(fā)的腦水腫死亡��,臨床試驗叫停�。在經(jīng)歷了幾個月的研究分析后���,公司并沒能找到確切的原因�,因此于2017年3月正式宣布放棄JCAR015���。競爭對手諾華和KitePharma獲得領(lǐng)先�����。盡管JCAR015出師未捷�����,Juno的CAR-T研發(fā)管線依然十分豐富����。同樣以CD19為靶點治療非霍基金淋巴瘤的還有2個產(chǎn)品-JCAR017和JCAR014,均處于臨床I期�����。不同于JCAR015使用CD28作為共刺激結(jié)構(gòu)域����、逆轉(zhuǎn)錄病毒作為表達載體(類似KitePharma技術(shù)),JCAR017和JCAR014均以4-1BB和慢病毒作為共刺激結(jié)構(gòu)域和表達載體(類似諾華技術(shù))����。JCAR017治療彌漫性大B細胞淋巴瘤(DLBCL)的I期臨床數(shù)據(jù)顯示,3個月和6個月內(nèi)��,分別有74%和50%的患者得到完全緩解��,且3級或以上的細胞因子釋放綜合癥和神經(jīng)毒性的發(fā)生率僅為1%和14%,安全性良好�����。公司計劃于2018年提交上市申請�。
2.2 未來的發(fā)展方向-新靶點����、新適應(yīng)癥
目前,以CD19為靶點的CAR-T產(chǎn)品研究相對較深入����,已上市的2個產(chǎn)品均是以CD19為靶點治療血液腫瘤。全球來看��,CAR-T的研發(fā)管線迅速擴張�,既包括新靶點的探索,如BCMA�����、CD123�、CD33等;也包括新適應(yīng)癥的拓展���,如由血液腫瘤向?qū)嶓w瘤進階�����。全球已有多家公司的項目推進到了臨床階段�,預計未來將陸續(xù)有針對不同腫瘤的CAR-T產(chǎn)品問世。
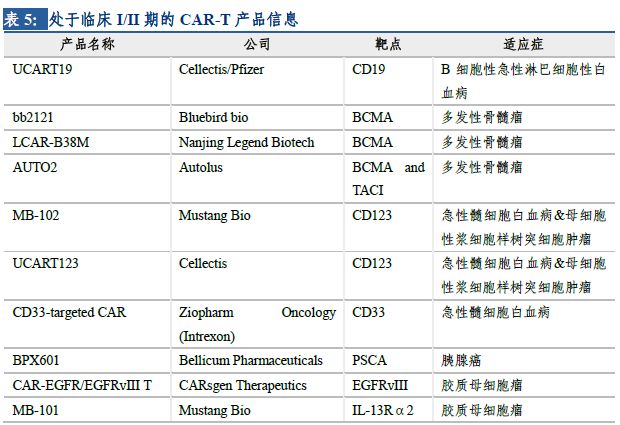

2.3 國內(nèi)發(fā)展逐漸步入正軌
伴隨CAR-T在國際上的快速發(fā)展�,我國細胞免疫療法也大致經(jīng)歷了寬松放開(第一階段)、“魏則西”事件后的短暫停滯(第二階段)以及現(xiàn)在的大浪淘沙��、行業(yè)洗牌(第三階段)���。行業(yè)有望向有序���、規(guī)范、健康的方向穩(wěn)步前進����。
?第一階段-全面放開、秩序混亂(2016年以前)
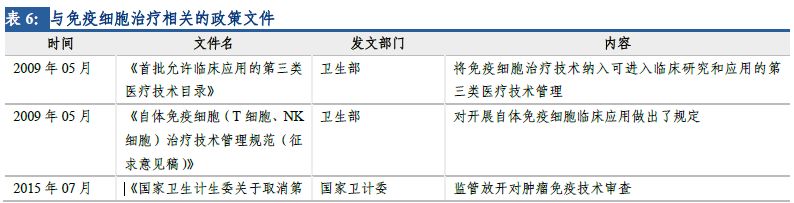
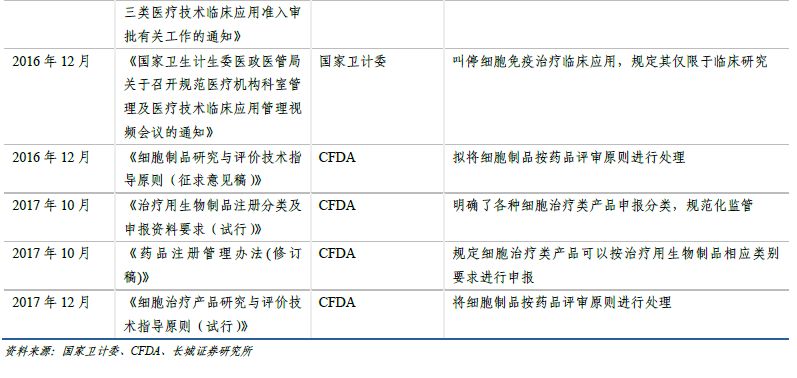
由于CAR-T療法具有特殊性�����,不同于常規(guī)藥物���,2009年衛(wèi)生部將免疫細胞治療技術(shù)納入可進入臨床研究和應(yīng)用的第三類醫(yī)療技術(shù)管理���。由于監(jiān)管體制相對寬松��,部分醫(yī)療機構(gòu)科室在沒有經(jīng)過衛(wèi)計委批準的情況下�����,紛紛開展免疫細胞治療項目,各種形式的臨床試驗和臨床應(yīng)用項目迅速增加��。
?第二階段-緊急叫停��、舉步維艱(2016年)
2016年4月�,“魏則西”事件經(jīng)過媒體宣傳持續(xù)發(fā)酵,在社會上造成巨大影響���,免疫細胞治療技術(shù)的濫用引起監(jiān)管部門高度重視��。5月���,衛(wèi)計委召開關(guān)于規(guī)范醫(yī)療機構(gòu)科室管理和醫(yī)療技術(shù)管理工作的電視電話會議,明確要求所有類型的免疫細胞治療技術(shù)停止應(yīng)用于臨床治療��,僅限于臨床研究。包括CAR-T在內(nèi)的免疫細胞治療在國內(nèi)進入停滯期��。
?第三階段-有序放開���、步入正軌(2017年至今)
2016年12月��,CDE發(fā)布了關(guān)于《細胞制品研究與評價技術(shù)指導原則》(征求意見稿)的通知��,根據(jù)征求意見稿�����,細胞制品未來將按藥品評審原則進行處理�����。2017年12月�,《細胞治療產(chǎn)品研究與評價技術(shù)指導原則(試行)》發(fā)布�����,提出了細胞治療產(chǎn)品從早期研發(fā)到生產(chǎn)����、從藥學研究��、非臨床研究�����,到臨床研究階段應(yīng)遵循的一般原則和基本要求���,初步規(guī)范了細胞治療產(chǎn)品的研究、開發(fā)與評價方法�,未來仍將逐步完善、細化與修訂��。指導原則框架和內(nèi)容科學合理�����,符合細胞治療產(chǎn)品作為藥品研發(fā)的規(guī)律�,這是行業(yè)的大洗牌����,促使提高產(chǎn)業(yè)門檻和監(jiān)管力度,一方面讓缺乏核心技術(shù)�����、不符合水準的企業(yè)自行淘汰,另一方面鼓勵合格研發(fā)機構(gòu)的細胞治療產(chǎn)品申報����,進一步推動我國細胞治療藥品產(chǎn)業(yè)的發(fā)展和壯大。
2.4中國位列第一梯隊��,熱門靶點競爭激烈
在全世界范圍內(nèi)����,CAR-T療法的臨床試驗正在大幅增加。美國是開展CAR-T臨床試驗最早的國家���,據(jù)ClinicTrail.gov的統(tǒng)計數(shù)據(jù)�,截至2017年4月��,美國登記開展CAR-T臨床研究達165項�,居全球首位。中國緊跟其后���,共計登記開展了158項CAR-T研究��,數(shù)量上僅次于美國����,超過全球注冊總數(shù)的40%,并呈逐年遞增趨勢��。
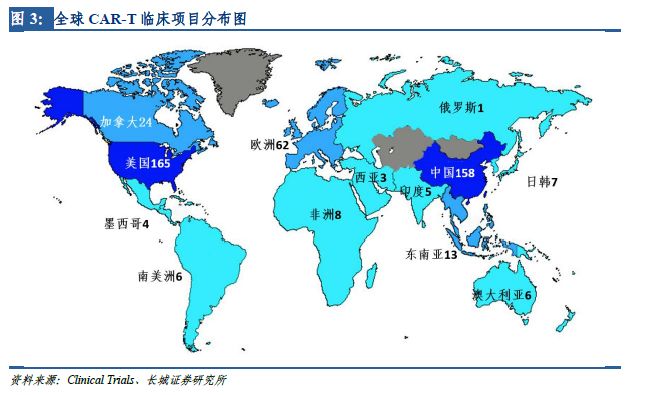

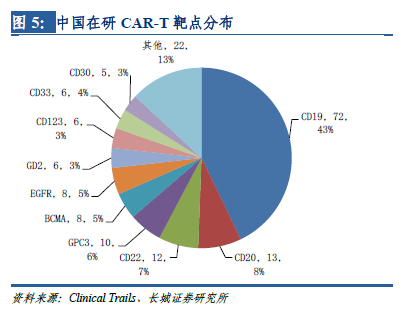
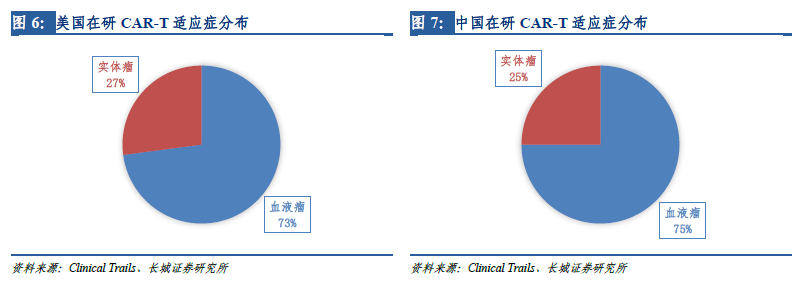
靶點決定適應(yīng)癥�����,從適應(yīng)癥上看����,有75%的在研CAR-T項目擬用于白血病、淋巴瘤等血液腫瘤��,僅有小部分的在研項目針對肝癌���、肺癌等實體腫瘤���,與美國在研CAR-T項目的適應(yīng)癥分布也非常類似�����。這是因為在早期的臨床試驗中�,CAR-T僅被證實可以顯著改善晚期血液腫瘤患者的預后,但在實體瘤上的突破直到近幾年才有所進展,各種實體瘤是CAR-T繼血液腫瘤之后的重要發(fā)展方向�����。
2.5 多個產(chǎn)品臨床申請獲得受理�����,3個納入優(yōu)先審評
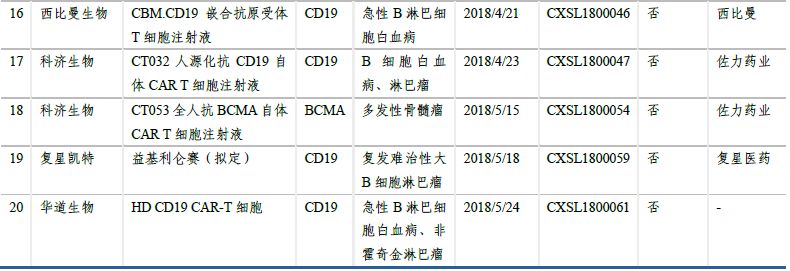
在日益增長的病患需求���、不斷推進的監(jiān)管制度和大量資金投入研發(fā)及合作的情況下���,國內(nèi)的細胞治療產(chǎn)業(yè)發(fā)展迅速,目前已形成了近百家不同規(guī)模的公司�����,且有多家已建立產(chǎn)業(yè)化基地�,覆蓋了從細胞存儲到細胞制劑制備、細胞治療技術(shù)研究等各方面����。CAR-T細胞治療在技術(shù)上愈發(fā)成熟、安全��、高效,制備工藝和臨床使用規(guī)程也將更加標準化�、自動化、精準化���。臨床申報方面��,南京傳奇生物的CAR-T療法獲得國內(nèi)首個按藥物申報的臨床批件��。截至2018年5月��,另有13家企業(yè)的19個CAR-T項目臨床申請獲得CDE受理��,絕大多數(shù)都是以CD19為靶點�����。預計未來3-5年����,國產(chǎn)CAR-T產(chǎn)品將陸續(xù)上市�����。
目前CAR-T是腫瘤精準治療的熱點前沿領(lǐng)域����,國內(nèi)有近百家不同規(guī)模的公司都在從事自主或合作研發(fā),未來免疫細胞治療將成為一片紅海市場����,最早上市的產(chǎn)品可占有搶占市場的先發(fā)優(yōu)勢。若能領(lǐng)先外資企業(yè)產(chǎn)品在國內(nèi)上市���,更有利于在激烈的市場競爭中立足��。然而目前CAR-T細胞制備仍然依賴傳統(tǒng)的人工操作�,細胞質(zhì)量和穩(wěn)定性都難以保證�����,療效也會因此大打折扣��。CAR-T按照藥物申請上市��,必然要通過生物制品質(zhì)量控制�����,可預見自動化生產(chǎn)是未來的大趨勢�����,一方面可滿足監(jiān)管機構(gòu)對藥品制備的要求,另一方面便于實施工藝優(yōu)化���,在大規(guī)模產(chǎn)業(yè)生產(chǎn)條件下(如數(shù)百上千份)降低生產(chǎn)成本�,才能在競爭中立于不敗之地�����。